我院李斌教授和瑞典皇家理工学院闫宏吉教授团队合作研究成果论文“Early osteoimmunomodulation by mucin hydrogels augments the healing and revascularization of rat critical-size calvarial bone defects”在《Bioact Mater》期刊发表。
大尺寸骨缺损的修复仍然是临床的一大挑战。自体骨移植一直是骨再生修复的金标准。然而,供量不足和继发性疾病等问题极大限制了自体骨的使用。人工合成的骨移植物具有来源广泛、性能可调的优点,已成为自体骨移植的替代方案。以往的研究主要关注材料的直接促成骨作用,但最近的研究表明早期免疫反应对后期成骨具有重要影响,具有骨免疫调节活性的移植材料的设计和制备受到越来越多的关注。
骨损伤发生后,正常的骨愈合伴随着急性炎症的缓解,以及巨噬细胞由促炎M1型向抗炎M2型的转化。有益的免疫系统-干细胞相互作用有助于血管新生、新骨形成以及组织重塑。然而,当急性炎症反应发展为长期的慢性炎症时,促炎型巨噬细胞等免疫细胞将分泌大量的炎症因子,造成干细胞凋亡和组织纤维化,从而导致修复进程停滞。因此,引发有利的免疫反应以促进骨再生修复具有广阔的应用前景。
粘蛋白是动物界普遍存在的糖蛋白,其覆盖于多种细胞的表面,形成粘液凝胶,阻止有害分子通过,在免疫调控中发挥着重要作用。例如肠粘蛋白聚糖可以通过结合其半乳糖凝集素-3受体蛋白诱导树突状细胞的免疫耐受,而粘蛋白水凝胶体内植入后能引发非常低的补体激活并抑制巨噬细胞的释放和激活。基于粘蛋白的免疫调控功能,新威尼斯v0008李斌教授联合瑞典皇家理工学院闫宏吉教授团队共同开发了基于粘蛋白水凝胶的骨修复材料,其可在骨损伤早期促使巨噬细胞极化为M2表型,促进早期血管生成,最终促进骨缺损愈合(图1)。
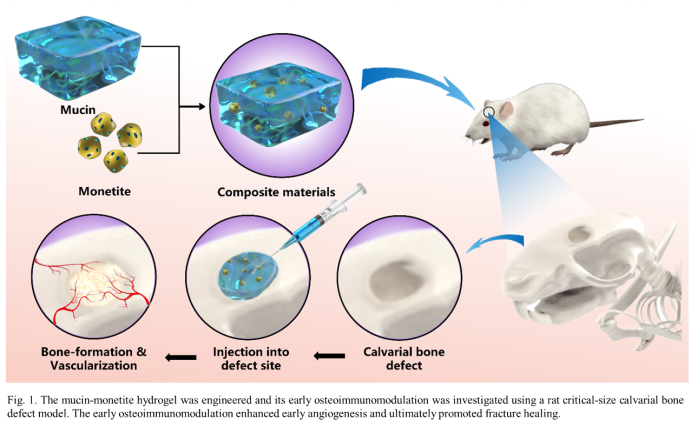
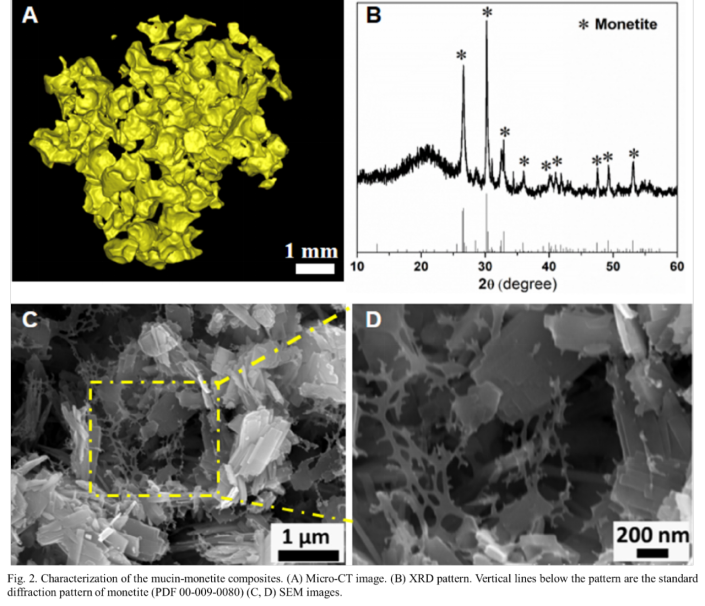
首先,研究人员制备了四嗪(Tz)和降冰片烯(Nb)修饰的牛颌下粘蛋白,它们可通过点击化学成胶(M-gel)。在此基础上,进一步制备了具有微纳结构的多孔三斜磷钙石,并将其与粘蛋白水凝胶混合,构建了可通过点击化学交联的粘蛋白-三斜磷钙石复合水凝胶。复合水凝胶中,三斜磷钙石呈现片状结构,粘蛋白水凝胶均匀连接于三斜磷钙石之间(图2)。
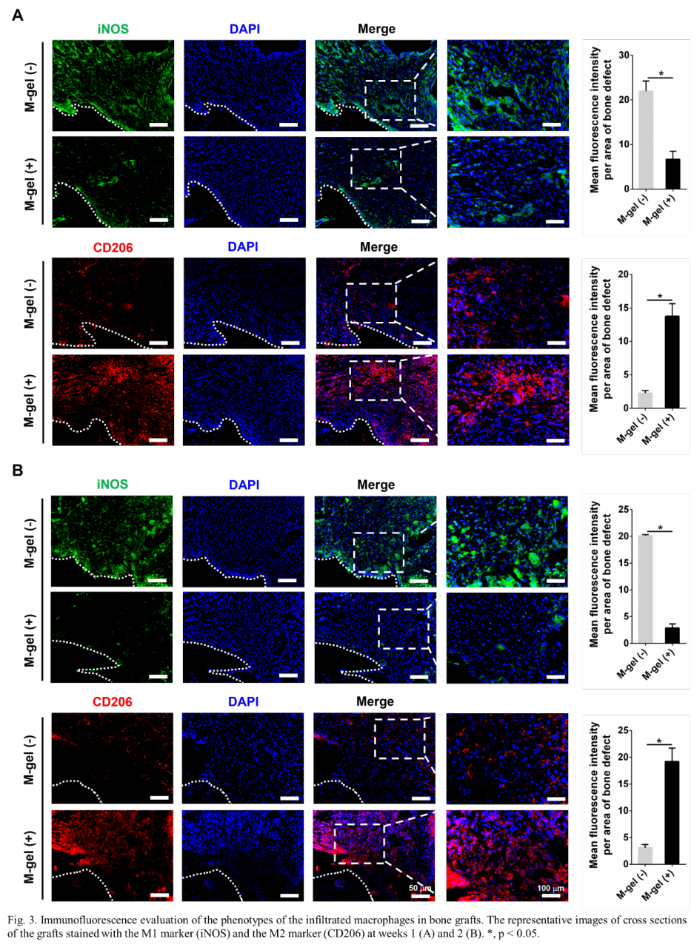
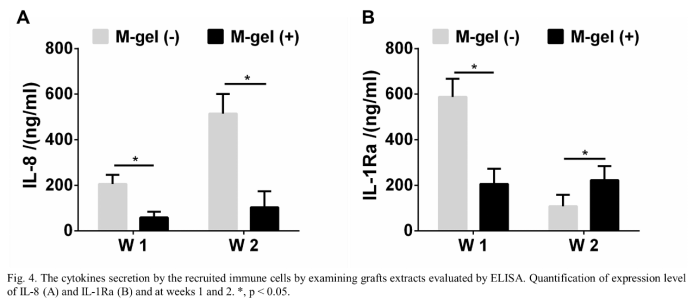
接着,研究人员建立了大鼠颅骨缺损模型,用以评估复合水凝胶的免疫成骨作用。在材料植入的第1周和第2周,免疫荧光染色结果表明,与M-gel(-)组相比,M-gel(+)组中M1巨噬细胞明显减少。与此同时, M2巨噬细胞在M-gel(+)组中的数量显著增加(图3)。缺损处的细胞因子检测也表明,M-gel(+)组中的炎症因子水平低于M-gel(-)组(图4)。这些结果表明,含粘蛋白的移植物可以在骨愈合过程的早期阶段促使巨噬细胞极化为M2表型,抑制炎症因子分泌,促进急性炎症反应的消退。
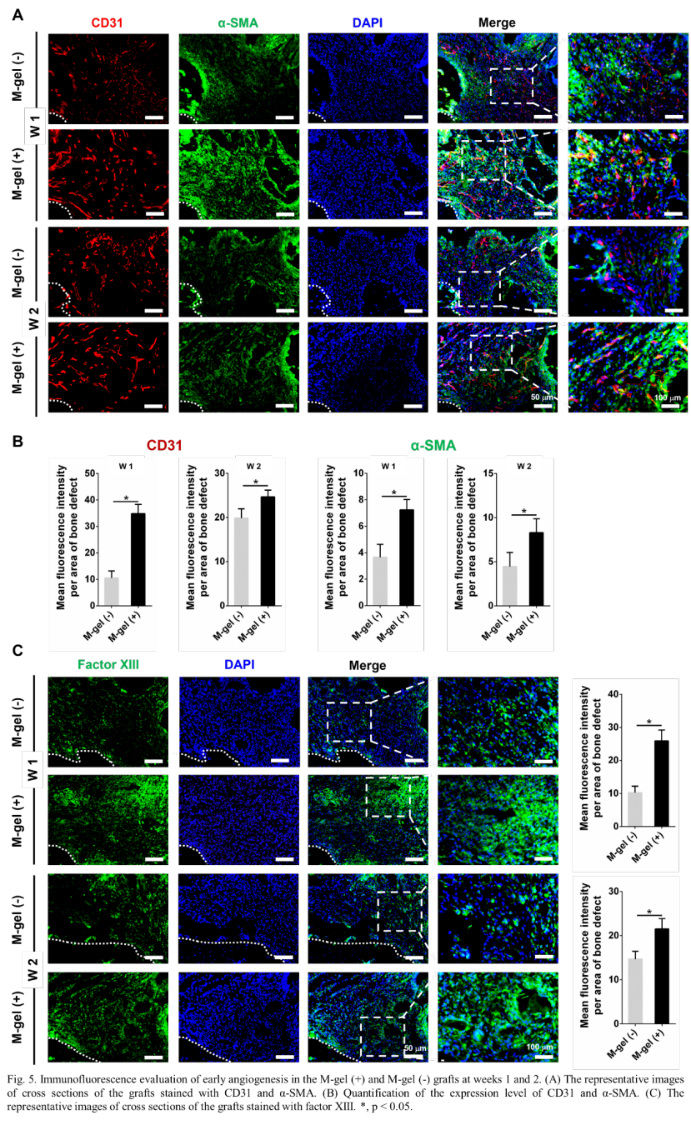
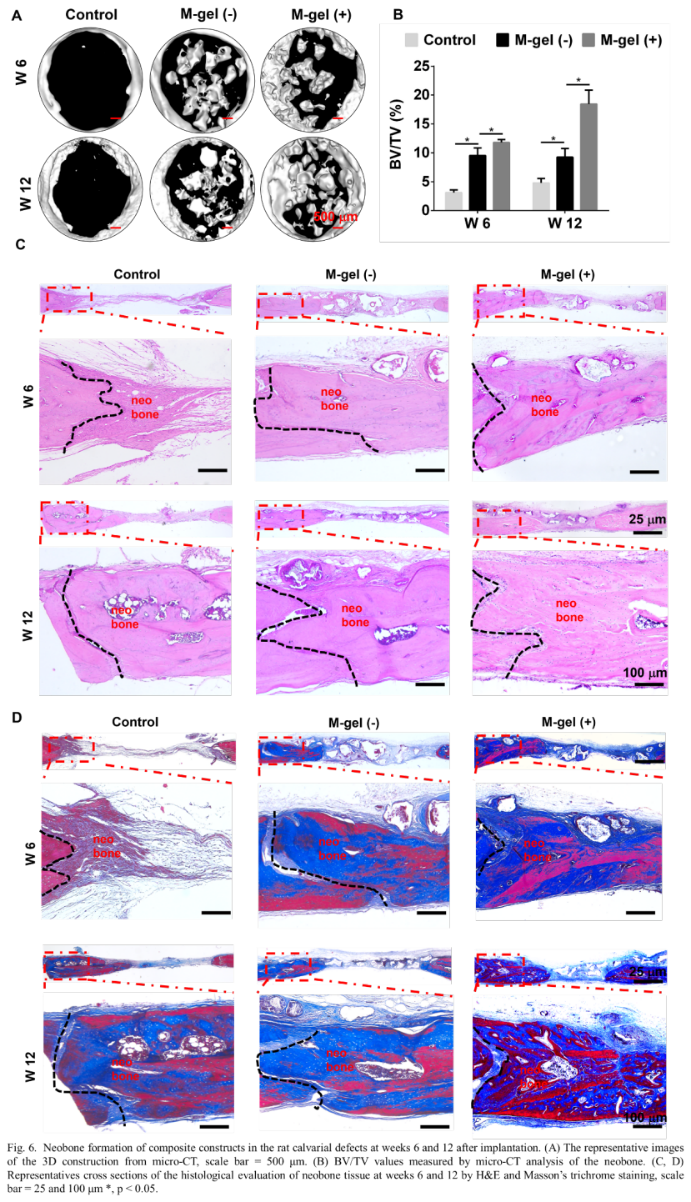
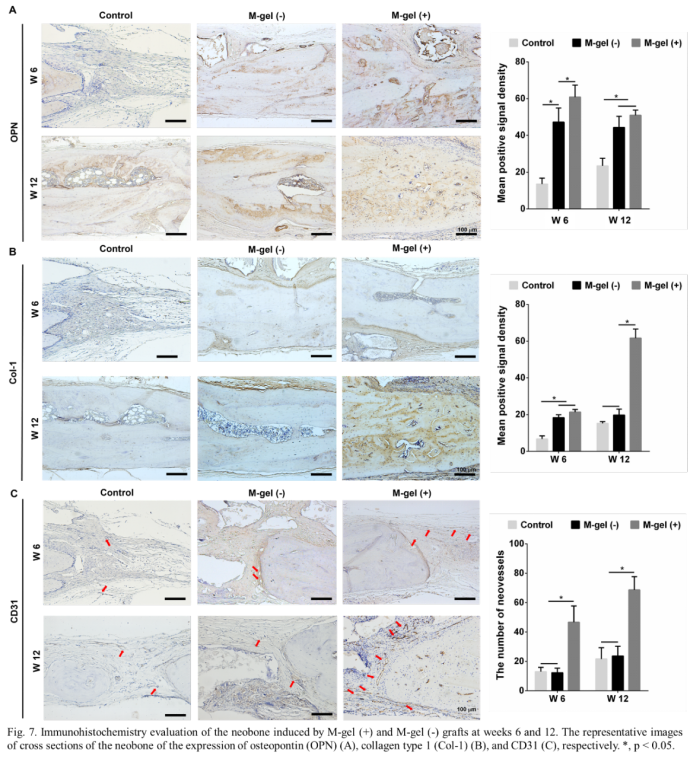
然后,研究人员在第1周和第2周对M-gel(+)组和M-gel(-)组进行早期血管生成检查。M-gel(+)移植物中CD31、α- SMA及因子XIII的表达明显高于M-gel(-) 移植物(图5)。其中CD31是血管内皮分化的重要标志物,α-SMA是血管平滑肌细胞的肌动蛋白异构体特征,因子XIII通过参与凝血级联的最后一步刺激新血管的形成。M-gel(+)移植物中α-SMA和因子XIII染色表明成熟血管的形成,表明粘蛋白在早期血管生成中的重要作用。体内成骨实验发现,与M-gel(-)移植组和对照组相比,M-gel(+)移植组缺损处的骨体积显著增加。此外,与第12周相比,M-gel(+)移植组的新骨体积从第6周增加了一倍。然而,M-gel(-)组在第6周至第12周的新骨体积增加明显较低。此外,组织学染色显示,在第6周和第12周,M-gel(+)移植组诱导的新骨比M-gel(-)移植组诱导的新骨有更多矿化骨和丰富的成骨细胞(图6)。免疫组化染色表明,与M-gel(-)移植物和对照组相比,M-gel(+)移植物中OPN和Col-1表达显著升高。内皮细胞标记物CD31染色显示,M-gel(+)移植物诱导更高的CD31表达,且形成直径更大的血管腔,而在M-gel(-)移植组和对照组中仅观察到少量微血管(图7C)。
最后,研究人员使用O-PTIR技术研究了不同组别中新骨的化学成分差异。结果表明M-gel(+)移植物中矿物质的分布更为广泛和密集(图8),进一步证实M-gel(+)组中具有更多的新骨生成。
原文链接:https://www.sciencedirect.com/science/article/pii/S2452199X23000348?via%3Dihub